“オルフォルグリプロン(orforglipron)は、第3相試験を無事に完了した最初の低分子GLP-1内服薬であり、投与量全体で平均1.3%から1.6%のHbA1Cを低下させた。
治験中の1日1回経口服用錠剤は、主要な副次評価項目において最高用量で平均16.0ポンド(7.9%)の体重減少を示した。
ACHIEVE-1試験におけるオルフォルグリプロンの全体的な安全性と忍容性プロファイルは、注射用GLP-1療法と一致していた。”*タイトル
*著者、雑誌名、公開年
Eli Lilly and Company (NYSE: LLY) , April 17, 2025
- 研究背景と目的
イーライ・リリー社は、2型糖尿病治療における新たな経口薬オプションとして、初の小分子GLP-1受容体作動薬「オルフォルグリプロン」の有効性と安全性を検証するため、第3相試験ACHIEVE-1を実施しました。
- 方法と結果
世界5カ国で559人の2型糖尿病患者を対象に、3つの用量でオルフォグリプロンを投与した結果、最大1.6%のA1C低下および7.9%(約7.3kg)の体重減少が確認されました。
- 考察と結論
本剤は、従来の注射型GLP-1製剤と同等の安全性プロファイルを持ちつつ、経口投与の利便性と高い有効性を示し、将来的な糖尿病治療の新たな選択肢となる可能性があります。
今回は、今人気の美容医療分野である痩身治療の最新情報をアップデートします!
次世代の肥満治療薬として臨床研究中の”オルフォルグリプロン”の第3相試験が無事完了し、40週間の投与で最大7.9%の体重減少効果がもたらされました。
製薬会社イーライ・リリー社による報告をまとめているのでぜひご覧ください。
イーライ・リリー社の新規 経口GLP-1受容体作動薬オルフォルグリプロンは、2型糖尿病患者を対象とした第3相試験において、血糖コントロールと体重減少の両面で有意な効果と安全性を確認
Eli Lilly and Company, プレスリリース(PR Newswire)、2025年4月17日公開
イーライリリー(NYSE: LLY)は本日、食事と運動のみでは血糖コントロールが不十分な成人2型糖尿病患者を対象に、オルフォルグリプロンの安全性と有効性をプラセボと比較評価するACHIEVE-1試験の良好なトップライン結果を発表しました。
オルフォルグリプロンは、食事や水分制限なしで服用できる、経口低分子グルカゴン様ペプチド-1(GLP-1)受容体作動薬として初めて、第3相試験を無事に完了しました。
承認されれば、イーライリリーは供給上の制約を受けることなく、オルフォルグリプロンを世界中で発売できると確信しています。
これは、2050年までに推定7億6,000万人の成人に影響を与えると予測される2型糖尿病などの慢性疾患の減少という、イーライリリーの使命をさらに推進するものです。
「ACHIEVE-1は、糖尿病と肥満の患者を対象にオルフォルグリプロンの安全性と有効性を検討する7つの第3相試験のうちの最初の試験です。
当社の最新のインクレチン薬が、安全性と忍容性、血糖コントロール、そして体重減少に関して期待通りの結果を示したことを嬉しく思います。今年後半に追加データが発表されることを期待しています」
リリー社の会長兼CEO デビッド・A・リックスは、
「オルフォルグリプロンは1日1回服用の便利な錠剤として新たな選択肢となる可能性があり、承認されれば、世界中の人々が使用できるよう、容易に製造・販売されるでしょう」と述べています。
ACHIEVEプログラムの最初の第3相試験では、オルフォルグリプロンは40週時点でプラセボと比較して優れたHbA1C低下という主要評価項目を達成し、有効性推定値を用いて、ベースラインの8.0%から平均1.3%~1.6%のHbA1c低下を示しました。
主要な副次評価項目では、オルフォルグリプロンの最高用量を服用した参加者の65%以上がHbA1c6.5%以下を達成しました。
追加の重要な副次評価項目において、オルフォルグリプロンを服用した参加者は、最高用量で平均16.0ポンド(7.9%)の減量に成功しました。
試験終了時点で参加者がまだ体重減少の停滞期に達していなかったことを考えると、まだ減量効果の伸びしろがあると考えられます。
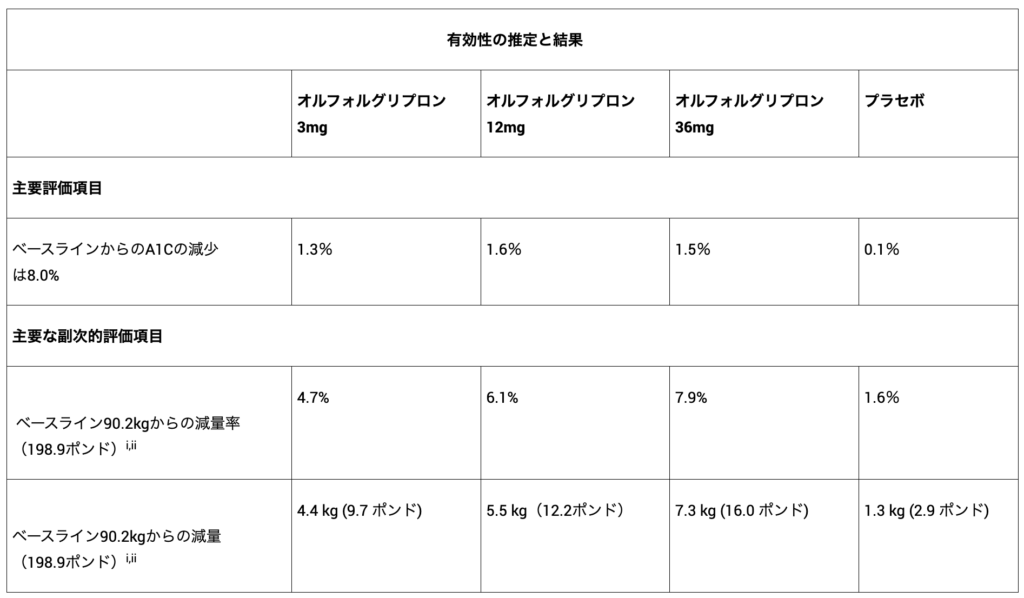
治療レジメンの推定値では、オルフォルグリプロンの各用量で統計的に有意なHbA1C値の低下が認められました。
主要な副次評価項目である体重では、12mgおよび36mgの用量で統計的に有意な減少が認められました。
- HbA1c低下率:1.2%(3 mg)、1.5%(12 mg)、1.5%(36 mg)、0.4%(プラセボ)
- 体重減少率: 4.5% (3 mg)、5.8% (12 mg)、7.6% (36 mg)、1.7% (プラセボ)
- 体重減少幅: 4.2 kg (9.3 ポンド; 3 mg)、5.2 kg (11.5 ポンド; 12 mg)、7.2 kg (15.8 ポンド; 36 mg)、1.5 kg (3.4 ポンド; プラセボ)
ACHIEVE-1試験におけるオルフォルグリプロンの全体的な安全性プロファイルは、確立されたGLP-1クラスと一致していました。
最も多く報告された有害事象は消化器系関連で、重症度は概ね軽度から中等度でした。
オルフォルグリプロン(それぞれ3mg、12mg、36mg)を投与された参加者における最も多く報告された有害事象は、下痢(それぞれ19%、21%、26%、プラセボ投与群の9%)、吐き気(それぞれ13%、18%、16%、プラセボ投与群の2%)、消化不良(それぞれ10%、20%、15%、プラセボ投与群の7%)、便秘(それぞれ8%、17%、14%、プラセボ投与群の4%)、嘔吐(それぞれ5%、7%、14%、プラセボ投与群の1%)でした。
有害事象による治療中止率は、オルフォルグリプロン3mg群で6%、12mg群で4%、36mg群で8%であったのに対し、プラセボ群では1%でした。
肝機能への安全性に関するシグナルは認められませんでした。
ACHIEVE-1の結果は、ADAの本研究は第85回学術会議で発表され、査読付き学術誌に掲載されました。
ACHIEVE第3相臨床試験プログラムの詳細な結果は、体重管理を目的としたオルフォルグリプロンを評価するATTAIN第3相臨床試験プログラムの知見とともに、今年後半に発表される予定です。
リリーは、体重管理を目的としたオルフォルグリプロンを今年末までに世界中の規制当局に申請する予定であり、2型糖尿病治療薬としての申請は2026年を予定しています。
オルフォルグリプロンについて
オルフォルグリプロンorforglipronは、1日1回服用する治験中の低分子(非ペプチド)経口グルカゴン様ペプチド-1受容体作動薬で、食事や水分摂取の制限なく一日中いつでも服用できます。
オルフォルグリプロンは、中外製薬株式会社が発見し、2018年にイーライリリーがライセンス供与しました。
中外製薬とイーライリリーは、この分子の前臨床薬理データを共同で発表しました。イーライリリーは、2型糖尿病の治療および少なくとも1つの体重関連の疾患を有する肥満または過体重の成人の体重管理を目的としたオルフォルグリプロンの第3相試験を実施しています。
また、肥満の成人の閉塞性睡眠時無呼吸症および高血圧の潜在的な治療薬としても研究されています。
ACHIEVE-1およびACHIEVE臨床試験プログラムについて
ACHIEVE-1(NCT05971940)は、食事療法と運動療法のみでは血糖コントロールが不十分な成人2型糖尿病患者を対象に、オルフォルグリプロン3mg、12mg、36mgを単剤療法としてプラセボと比較する第3相、40週間、無作為化、二重盲検、プラセボ対照試験です。
アメリカ、中国、インド、日本、メキシコにおいて総勢559名の被験者を対象に研究が行われています。
オルフォルグリプロン3mg、12mg、または36mg、あるいはプラセボを投与する群に割り付けました。
本試験の目的は、2型糖尿病患者で、初回来院前90日間以上糖尿病治療薬を服用しておらず、インスリン療法未経験者を対象とし、オルフォルグリプロン(3mg、12mg、36mg)がプラセボと比較して、40週後のベースラインからのHbA1c低下において優れていることを証明することでした。
試験参加者のHbA1cは7.0%以上9.5%以下、BMIは23kg/m²以上でした。
オルフォルグリプロン投与群の全参加者は、オルフォルグリプロン1mgを1日1回投与する用量で試験を開始し、その後4週間ごとに段階的に用量を増量し、最終的にランダム化維持用量である3mg(1mg単位)、12m(1mg、3mg、6mg単位)、または36mg(1mg、3mg、6mg、12mg、24mg単位)まで増量しました。
オルフォルグリプロンのACHIEVEフェーズ3国際臨床開発プログラムでは、5つの国際登録試験に6,000人以上の2型糖尿病患者が登録されています。
このプログラムは2023年に開始され、今年後半から2026年にかけて結果が出る予定です。